Warning: include(/data/htdocs/hebergementweb/sites/imagemed.univ-rennes1.fr/fr/nav.html): failed to open stream: No such file or directory in /data/htdocs/hebergementweb/sites/imagemed.univ-rennes1.fr/template.php on line 144
Warning: include(): Failed opening '/data/htdocs/hebergementweb/sites/imagemed.univ-rennes1.fr/fr/nav.html' for inclusion (include_path='.:/usr/share/pear:/data/htdocs/hebergementweb/php-include') in /data/htdocs/hebergementweb/sites/imagemed.univ-rennes1.fr/template.php on line 144
Principe de la quantification conjointe du fer et de la graisse hépatique par IRM

Résumé
La concentration hépatique en fer (CHF) doit être estimée de préférence par le calcul du R2* (inverse du T2*) plutôt que par le rapport d'intensité de signal entre le foie et les muscles paravertébraux (méthode SIR).
L'évaluation de la fraction graisseuse (FF) doit se faire en densité de protons (PDFF) via l'imagerie de phase en analysant la variation du signal selon les différents temps d'échos en phase et en opposition de phase, de préférence sur plus d'un cycle.
Une estimation conjointe est possible avec la même séquence en apnée. Elle est même indispensable car chaque surcharge peut influencer la quantification de l'autre surcharge.
Une séquence générique et un logiciel de calcul sont proposés sur ce site.

Quantification du fer hépatique
L'objectif est de fournir une estimation de la concentration hépatique en fer (CHC) exprimée soit en mg/g de foie en poids sec avec une valeur normale maximale de 2mg/g de foie, soit plutôt en µmol/g avec une valeur supérieure limite à 36µmol/g de foie (NB : il y a une relation de 1 à 18 entre mg et µmol).
Le fer dans le foie entraine une diminution importante du signal hépatique par effet superparamagnétique. C'est lié à un raccourcissement du T2 en spin-echo mais surtout du T2* en écho de gradient. Cet effet augmente aussi avec la puissance du champ magnétique.
Si l'on dispose d'une séquence en écho de gradient avec de nombreux échos (une dizaine par exemple) on peut observer la décroissance progressive du signal au fur et à mesure que le TE augmente. Vous pouvez voir cela sur le simulateur. Avec les valeurs on peut faire l'opération inverse et essayer de retrouver les deux paramètres principaux (signal initial du foie et T2*) qui donnent une courbe la plus proche possible de celle observée. Après avoir obtenu le T2*, il est plus pratique de calculer son inverse le R2* (= la relaxivité) car il est proportionnel à surcharge en fer (et au champ magnétique). De façon grossière on peut considérer que la CHF en µmol/g = R2*/champ magnétique (1,5 ou 3T). Pour être plus précis il faut utiliser l'outil on-line ou le logiciel java MRQuantif.
On peut construire une séquence en écho de gradient adaptée comportant de multiples échos sur tous les appareils. Pour General Electric il faut disposer d'une option particulière "STARMAP" ou sinon répèter une série adaptée en changeant uniquement le temps d'écho et ensuite les fusionner avec l'outil on-line ou le logiciel java MRQuantif. On peut aussi acheter un module spécialisé qui produit une carte du R2*.
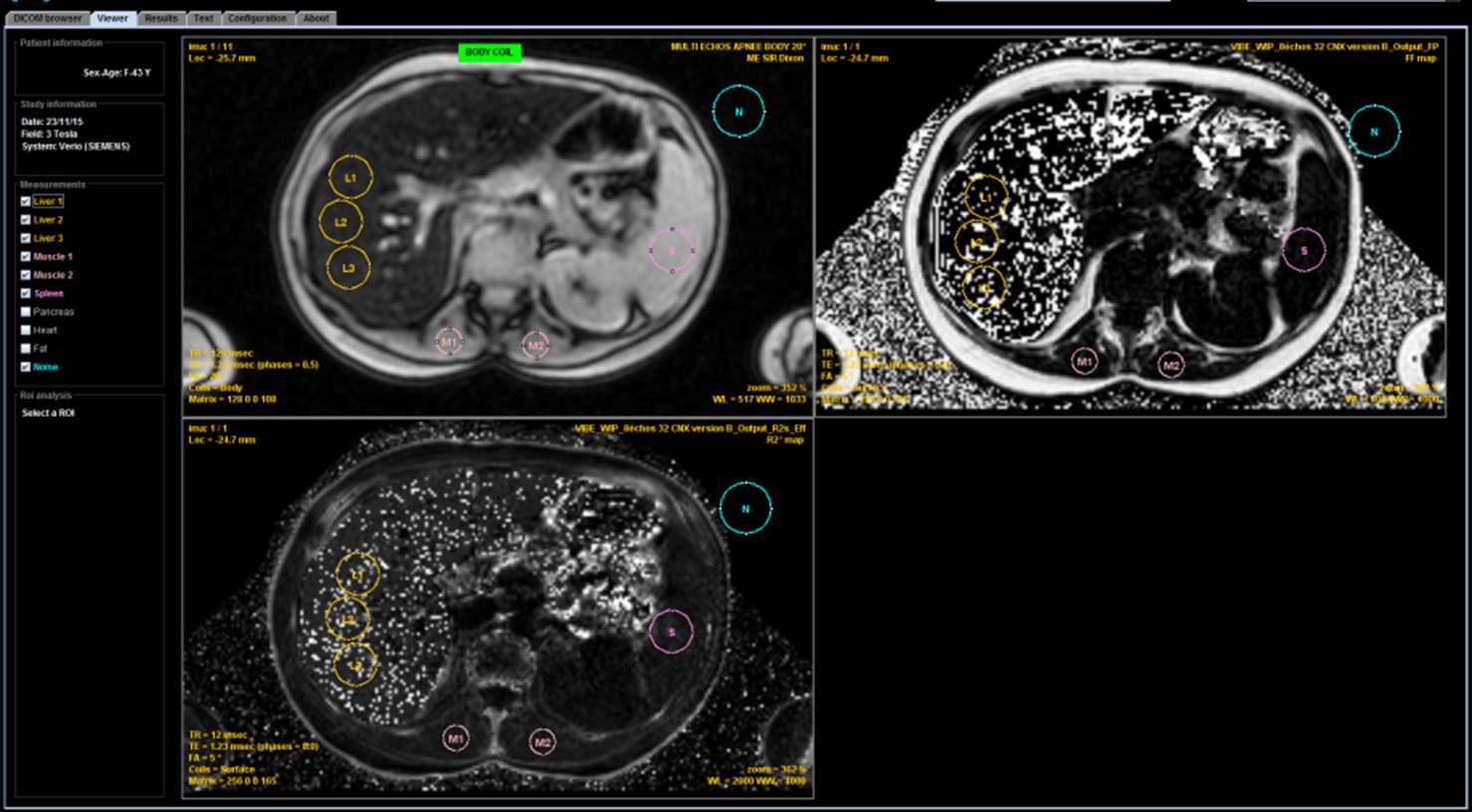
La limite principale de cette méthode est le risque de sous-estimation, potentiellement majeure, du R2* en cas de très forte surcharge entrainant un effondrement du signal. On comprend bien qu'il n'est possible de calculer correctement la décroissance que si le signal de départ, celui de l'écho le plus court, n'est pas effondré. Si vous mettez 600 µmol de CHF dans le simulateur vous n'avez plus de signal sur un premier écho à 1,2 ms. Une séquence avec un premier écho à 0,8 ms peut être configurée mais ce n'est pas possible sur tous les appareils. C'est pourquoi nous recommandons d'obtenir la séquence avec l'antenne corps, non pas celle qui est placée autour du patient mais celle qui est intégrée dans la paroi du tunnel, afin de prendre les muscles paravertébraux comme référence. Toutes les antennes de surface doivent être désactivées.
L'alternative au calcul du R2* est le calcul du rapport de signal entre le foie et les muscles paravertébraux (méthode SIR initialement proposée) à la condition formelle d'avoir utilisé uniquement l'antenne corps. Cette méthode est intégrée dans l'outil on-line ou le logiciel java MRQuantif
En histologie, en cas de surcharge en fer, une coloration de Perls met en evidence des éléments bleus correspondant aux dépôts de fer. La concentration hépatique en fer (CHC) a été longtemps déterminée par l'analyse biochimique du fragment de biopsie et est exprimée soit en mg/g de foie en poids sec avec une valeur normale maximale de 2mg/g, soit en µmol/g avec une valeur supérieure limite à 36µmol/g car il y a une relation de 1 à 18 entre mg et µmol. Cette méthode entraine la destruction du bloc de biopsie. Elle est de moins en moins réalisée et remplacée par l'IRM.
L'IRM est une technique sensible à l'existence de fer au sein des tissus. En effet, le fer est une substance paramagnétique qui devient superparamagnétique (apparition d’une relaxation prédominant nettement sur le T2*), lorsque plusieurs atomes sont regroupés comme cela s’observe au sein de l’hémosidérine. Dans le cadre d’une surcharge en fer, sa présence au niveau du foie entraîne donc une baisse importante du signal par effondrement du temps de relaxation T2*. Cet hyposignal se majore avec l’importance de la surcharge. Il est plus facile à détecter en utilisant des séquences en écho de gradient car elles comportent un rephasage par des gradients de champ magnétique et non pas par onde de radiofréquence à 180°. Ceci les rend plus sensibles à l’hétérogénéité locale du champ magnétique. La baisse de signal est alors spécifique si l’on choisit des temps d’écho en phase pour supprimer l’influence de la graisse.
La quantification précise de la surcharge en fer peut se faire par deux méthodes qui ont été validées dans la littérature. Elles ont chacune leurs avantages et leurs inconvénients (20). On les a longtemps opposées mais en pratique elles peuvent être complémentaires.
Le rapport foie sur muscle ou SIR (signal intensity ratio)
C’est la méthode que nous avons initialement proposée (Lancet 2004) et qui a été également reprise par Alustiza (Radiology 2004) avec une formule basée sur 2 échos. Rose (Eur J Haematol 2006) a proposé d'ajouter une séquence avec TE court, en opposition de phase, pour les fortes surcharges.
Elle simple à mettre en œuvre et elle a longtemps été la plus utilisée car elle ne nécessite aucune contrainte technique. Elle compense l'absence de valeur calibrée en IRM par une valeur relative en comparant quantitativement le signal du foie à celui des muscles paravertébraux. Ceci impose d’utiliser l’antenne corps intégrée dans la paroi du tunnel, sans aucune intervention des antennes de surface en particulier celles intégrées dans le lit afin d'éviter tout gradient de signal entre la surface et la profondeur. Ensuite, il faut appliquer un protocole d’acquisition strict, basé sur des séquences en écho de gradient en apnée avec un TR de 120 ms, un angle de bascule de 20° et des TE en phase pour limiter l’influence de la graisse. Les valeurs des TEs sont donc dépendantes du champ magnétique. Un premier écho très court, en opposition de phase, peut être ajouté pour quantifier les très fortes surcharges mais il ne faut le prendre en compte qu'en cas de forte surcharge avec une décroissance régulière du signal sur les échos successifs et ne pas l'utiliser en cas d'ondulation du signal en lien avec une stéatose.
| Séquence | TR (ms) | FA (°) | TE (ms) | |
|---|---|---|---|---|
| 1,5T | 3T | |||
| Out | 120 | 20 | 2.4 | 1.2 |
| DP | 120 | 20 | 4.8 | 2.4 |
| T2 | 120 | 20 | 9.6 | 4.8 |
| T2+ | 120 | 20 | 14 | 9.6 |
Ces séquences mono-écho peuvent se réduire à une seule si on peut acquérir une séquence multi-échos comportant des TE multiples de 1.2 ou 2.4 ms à 1,5T ou de 1.2 ms à 3T. Il faut cependant faire attention à bien obtenir tous les temps d'échos en phase nécessaires au calcul.
Chez un patient normal, le signal du foie est supérieur à celui du muscle sur les TE courts et ne descend que légèrement en dessous de celui du muscle sur les TE les plus longs.
En cas de surcharge en fer modérée, le signal du foie est proche de celui du muscle sur les TE les plus courts et descend rapidement en dessous de celui du muscle avec l'allongement du TE.
En cas de surcharge en fer importante, le signal du foie est déjà inférieur à celui du muscle sur les TE les plus courts et s'effondre rapidement avec l'allongement du TE.
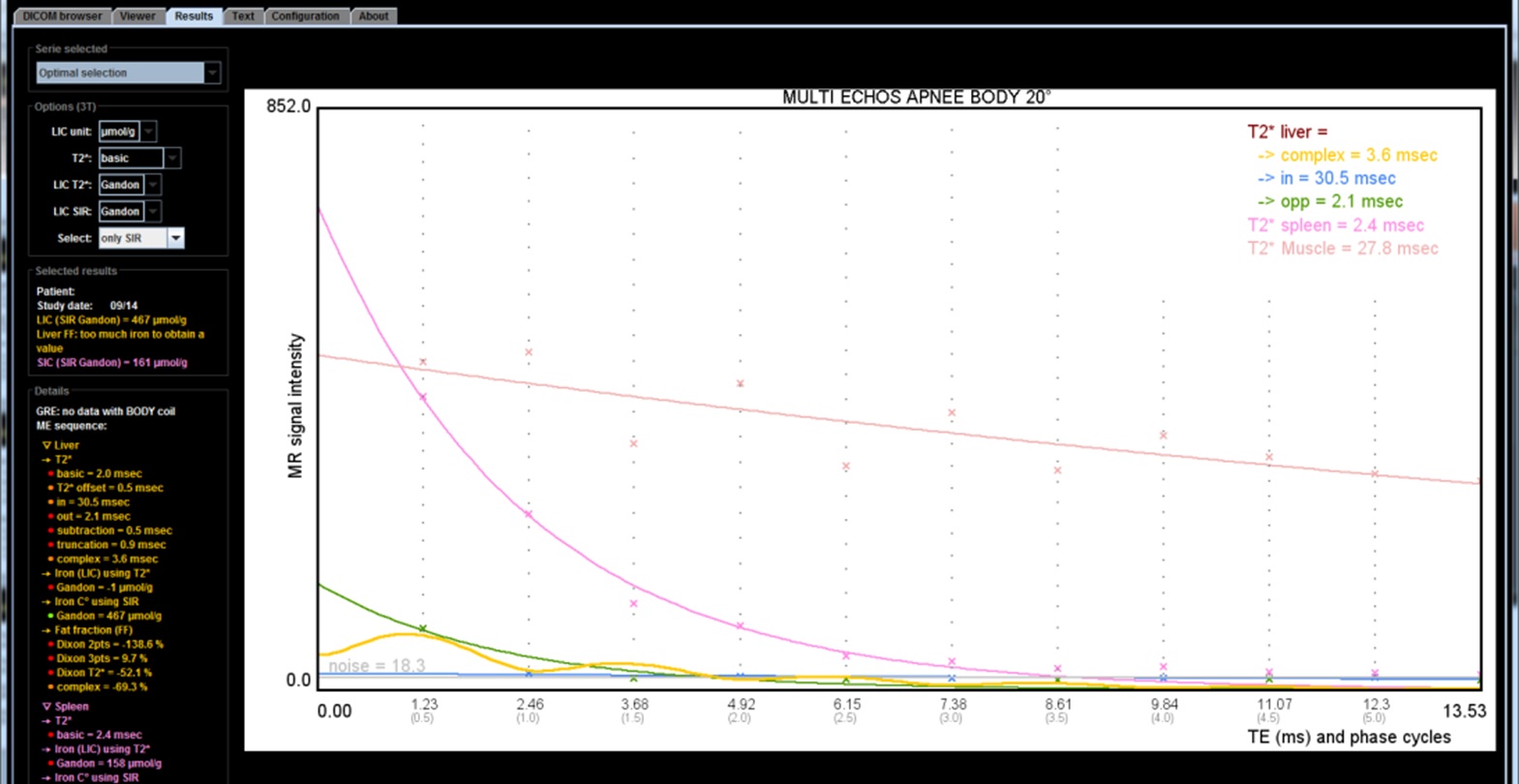
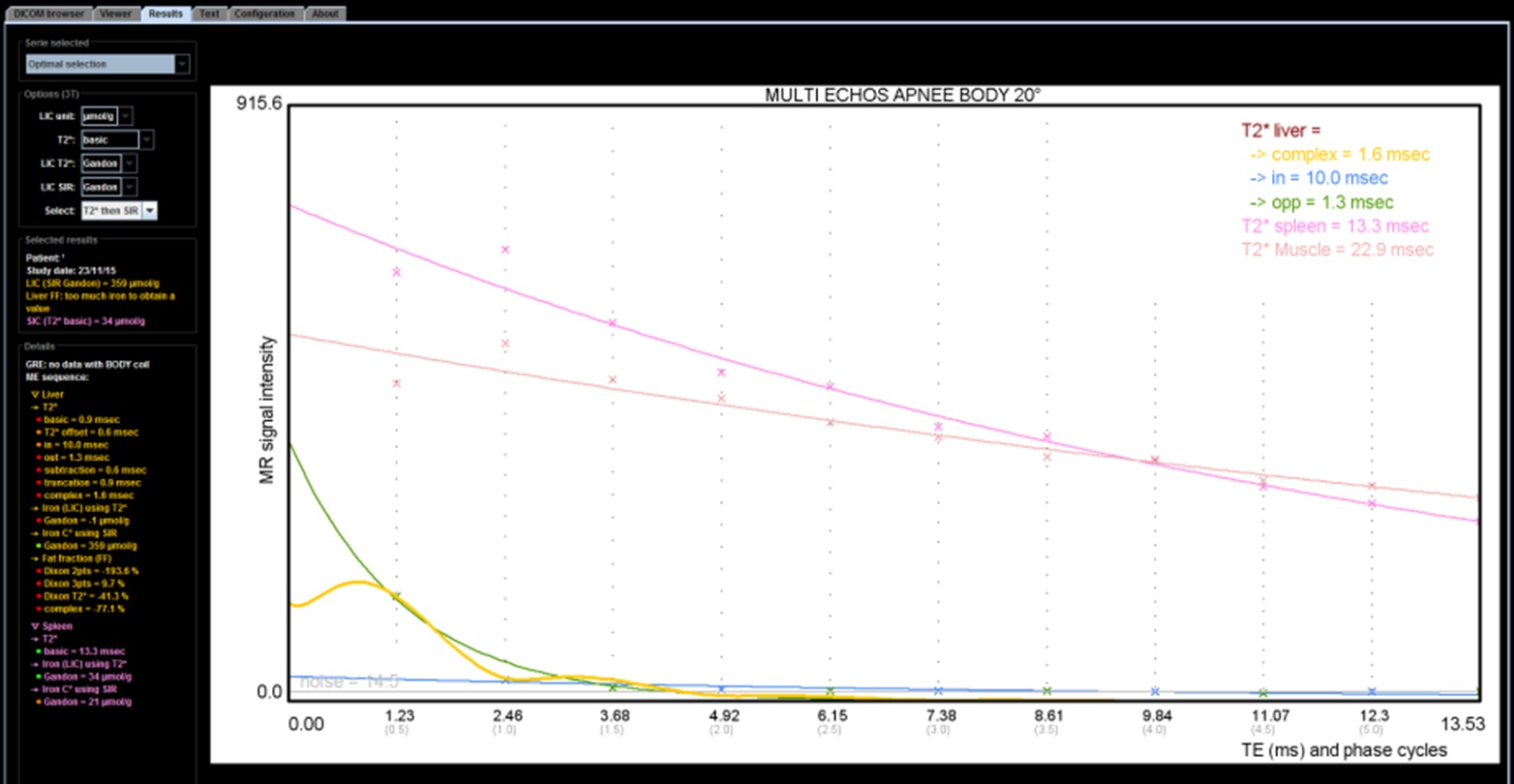
Si l'on a acquis une séquence multi-echos, le logiciel MRQuantif fournit une courbe du signal du foie, de la rate et du muscle en fonction du TE ce qui permet d'apprécier d'un seul coup d'oeil l'évolution du signal hépatique. L'ondulation du signal (ou l'écart entre les courbes du signal en phase et celui du signal en opposition de phase) traduit la présence de graisse associée.
Mais pour obtenir une quantification précise, il faut effectuer plusieurs mesures par une ROI sur les zones les plus homogènes du foie et des muscles para vertébraux. Pour éviter de possible erreurs, potentiellement graves, si l'antenne du tunnel n'as pas été utilisée isolément il est maintenant demandé de migrer vers un le logiciel DICOM MRQuantif qui contrôle les paramètres d'acquisition.
A 1,5 Tesla
Deux méthodes SIR de calcul ont été publiées : la notre "Gandon" correspondant au calcul en ligne, qui, en accord avec la publication de Castiella, surestime certainement les surcharges moyennes, et "Alustiza" qui donne des valeurs inférieures mais plus cohérentes avec les valeurs obtenues par le T2*. Afin de rendre les valeurs plus comparables le logiciel propose maintenant par défaut l'algorithme d'Alustiza. Au fur et à mesure de l'évolution de nos connaissances on adaptera l'outil MRQuantif pour qu'il vous fournisse en toutes circonstances la valeur la plus robuste. Cependant nous verrons qu'il est sans doute préférable d'utiliser le calcul du R2* (1/T2*) pour les surcharges faibles ou modérées et de passer à la méthode SIR pour les fortes surcharges.
| Ref | Patients | With biopsies | LIC range (µmolg/g) |
Sequence | Matrix | TR (ms) |
FA (°) |
TE-min (ms) |
N TEs | TE-max (ms) |
Method | Correlation (R) | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Gandon The Lancet 2004 |
113 patients + 61 controls |
174: with cirhosis (n=39), with steatosis (n=31) |
0-709 | GRE mono echo |
256×128 | 120 | 20 | 4 | 4 | 21 | on-line calculator | 0.87-0.92 | ||
| Alustiza Radiology 2004 |
44 patients + 68 controls |
112 | 0-390 | GRE mono echo |
256×128 | 120 | 20 | 4 | 3 | 21 | formula | 0.94 | ||
| Rose Eur J Haematol 2006 |
25 patients + 2 controls |
27 | 25-972 | GRE mono echo |
256×128 | 120 | 20 | 1.8 | 5 | 21 | formula for high overload using 1.8 ms TE |
0.85 | ||
| Castiella Eur Radiol 2011 |
64 patients (20 new) + 107 controls (39 new) |
112 published(Alustiza) +59 new |
0-390 | GRE mono echo |
256×128 | 120 | 20 | 4 | 3 | 21 | 31 patients at 1T, TE 9 ms missing |
0.86 | ||
| Total of 372 biopsies | ||||||||||||||
A 3 Tesla
Il n'y a que notre algorithme publié en 2017 dans Abdominal radiology. Il a été parfaitement étalonné en confrontation aux biopsies. Il donne un résultat identique à la méthode du T2* en appliquant notre formule de conversion (European radiology 2017). A ce champ magnétique le T2* est deux fois plus court et se réduit très vite en cas de surcharge en fer. Nous verrons qu'il peut devenir difficile d'obtenir des TE suffisamment courts pour calculer un T2* effondré. Dans ces circonstances la méthode SIR est préférable et le logiciel choisit en fonction du résultat la méthode optimale.
| Ref | Patients | With biopsies | LIC range (µmolg/g) |
Sequence | Matrix | TR (ms) |
FA (°) |
TE-min (ms) |
N TEs | TE-max (ms) |
Method | Correlation (R) | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Paisant Abd Radiol 2017 |
105 patients | 105: hemochromatosis (n=31) DIOS (n=22) others (n=3) controls (n=49) |
0-630 | GRE mono echo |
106×128 | 120 | 20 | 1.2 | 5 | 14 | on-line calculator | 0.96 | ||
| Total of 105 biopsies | ||||||||||||||
La relaxométrie via le calcul du R2 (=1/T2) ou du R2* (=1/T2*) et sa conversion en concentration hépatique en fer
Le T2 est le paramètre de la décroissance exponentielle du signal observé en écho de spin. La relaxométrie R2 est a priori moins performante que la relaxométrie R2* mais le FerriScan est la seule solution commerciale approuvée par la FDA.
Le T2* est le paramètre de la décroissance exponentielle du signal observé en écho de gradient. Il décroit rapidement en cas de présence de fer sous la forme cristalline, comme dans le cas de l'hémosidérine qui est la forme de stockage du fer hépatique. Le T2* peut être calculé à partir du signal mesuré sur une séquence comportant plusieurs échos par une méthode d'optimisation (Levenberg-Marquardt ou simplexe) en utilisant la formule de décroissance du signal :
Le R2* est proportionnel à la concentration en fer mais aussi au champ magnétique.
En pratique, il y a plusieurs façons de calculer le R2* dans le logiciel MRQuantif. La technique optimale est sélectionnée par défaut mais on peut la changer via un menu déroulant dans les options de calcul :
- R2* basic avec truncation : c'est le calcul du T2* en prenant toutes les mesures du signal du foie, sans tenir compte de la phase, mais en s'arrêtant de prendre en compte les valeurs du signal hépatique à partir de la première mesure qui est égale ou inférieure au bruit de fond. C'est certainement la méthode la plus logique mais elle peut aussi être prise en défaut si le signal est effondré.
- R2* basic avec truncation et extrapolation : on ajoute une valeur minimale du signal de départ du foie en se basant sur le signal du muscle (uniquement possible si l'acquisition a été obtenue avec l'antenne corps).
- R2* complex : le calcul se fait en intégrant dans l'équation le pourcentage de graisse et son influence sur le signal. C'est la meilleure méthode théorique et la seule applicable réellement en cas de stéatose. Mais à l'inverse l'introduction d'une nouvelle inconnue lui fait perdre un peu de robustesse. En cas de très forte surcharge en fer, elle peut aboutir à des résultats aberrants avec un R2* sous-estimé et une surcharge en graisse très élevée alors qu'en fait il n'y a pas de stéatose.
Le T2* est donc la valeur numérique absolue qui apprécie directement la présence de fer. Elle a mis de nombreuses années à passer au premier plan car elle impose idéalement une séquence multi-échos. La première publication d'importance qui a établi cette méthode est celle de Wood (Blood 2005) mais à cette époque Wood a réalisé des séquences mono-écho répétées sans re-calibration. Le TE le plus court utilisé était de 0,8ms. Pour obtenir cette valeur il a du réduire la matrice à 64x64 pixels.Aujourd'hui tous les principaux contructeurs proposent une séquence multiéchos 2D ou 3D mais il n'est pas facile de descendre le premier TE en dessous de 1 ms. C'est ce qui a été fait pour les études plus récentes.
A 1,5 Tesla
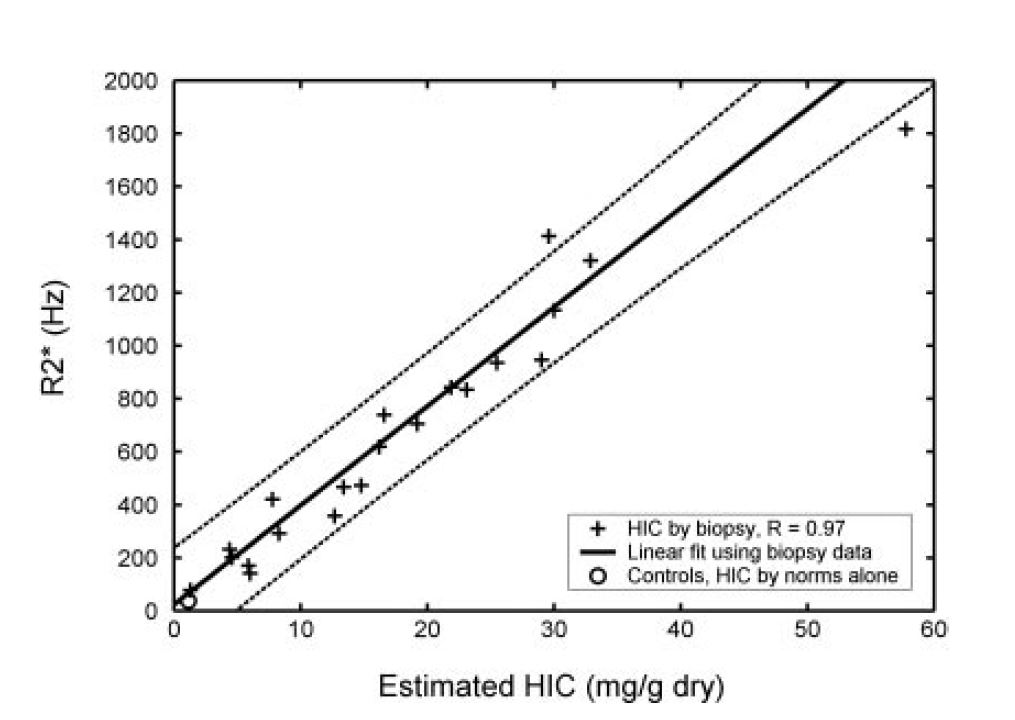
Plusieurs études ont confronté les résultats du calcul du R2* à celui de la CHF obtenue par biopsie. Les principales sont :
| Ref | Patients | With biopsies | LIC range (mg/g) |
Sequence | Matrix | TR (ms) |
FA (°) |
TE-min (ms) |
delta-TE (ms) |
N TEs | TE-max (ms) |
Comment | Method | Correlation (R) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Anderson Eur Heart J 2001 |
27 patients | 27 (29 biopsies): β-thalassemia | 1-26 | GRE mono echo |
96×128 | 200 | 20 | 2.2 | 2.56 | 8 | 20.1 | offset | 0.68 (fibrosis) 0.93 (others) |
|
| Wood Blood 2005 |
102 patients + 13 controls |
22: thalassemia major (n=9), sickle cell disease (n=10), thalassemia intermedia (n=2), Blackfan-Diamond syndrome (n=1) |
1.3-32.9 et 57.8 |
GRE mono echo |
64x64 | 25 | 20 | 0.8 | 0.25 | 16 | 4.8 | Controls: R2* = 39 s-1 T2* = 25 ms. |
offset | 0.97 |
| Hankins Blood 2009 |
43 patients | 43: sickle cell disease (n=32), thalassemia major (n=6), bone marrow failure (n=5) |
0.6-27.6 NB: 2 <2mg/g |
GRE multi echoes |
? | ? | ? | 1.1 | 0.8 | 20 | 17,3 | truncated | 0.97 | |
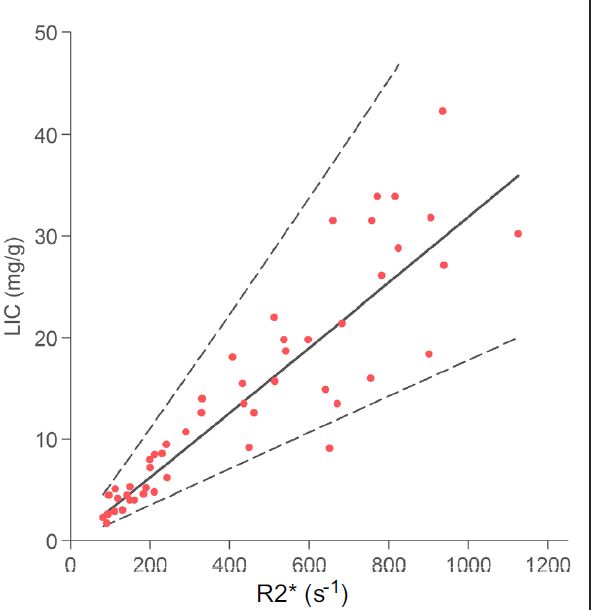
| Garbowski J Cardiovasc Magn Reson 2014 |
121 patients 31 controls |
25 (50 biopsies): βthalassemia (n=20), Blackfan-Diamond syndrome (n=1), congenital sideroblastic anemia (n=2), pyruvate kinase deficiency (n=1) |
1.7-42.3 NB: 1 <2mg/g |
GRE multi echoes |
? | ? | ? | 1.1 | 0.8 | 20 | 17,3 | Controls: R2* = 37 s-1 T2* = 27 ms. |
truncated | 0.94 |
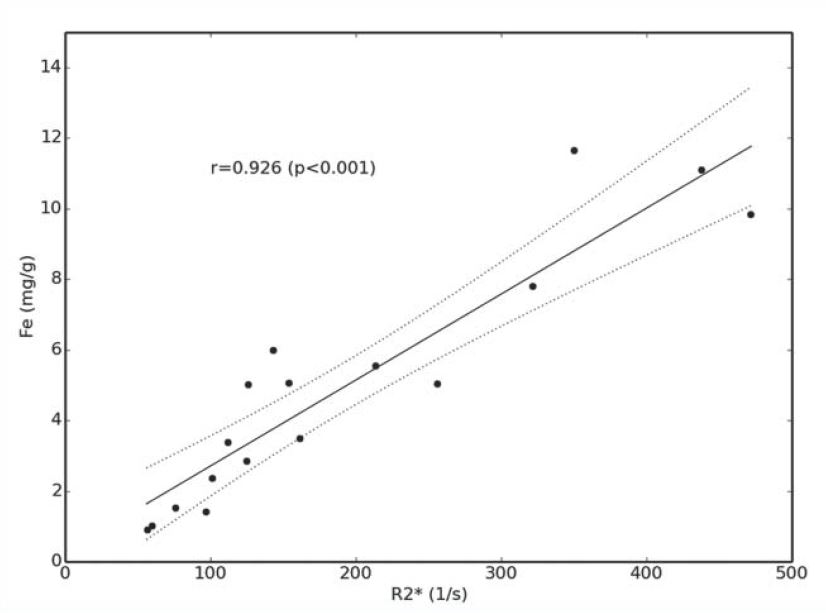
| Henninger RöFo 2015 |
17 patients | 17: hemochromatosis (n=10), DIOS (n=2), aceruloplasminemia (n=2), congenital sideroblastic anemia (n=1), spur cell aenemia (n=1) |
0.92-11.65 NB: 4 <2mg/g |
GRE multi echoes |
128x128 | 200 | 20 | 0.99 | 1.41 | 12 | 16.5 | fat suppression | truncated | 0.92 |
| Total of 161 biopsies | ||||||||||||||
En regardant les principales courbes corrélant le R2* et la LIC exprimée en en mg/g on voit que la quantification devient incertaine au delà de 30 mg/g à 1,5T, et même moins dans l'étude de Garbowski :
Graphiquement voici la comparaison des corrélations publiées (R2* versus LIC exprimée en mg/g, multiplier par 18 pour les µmol/g) :
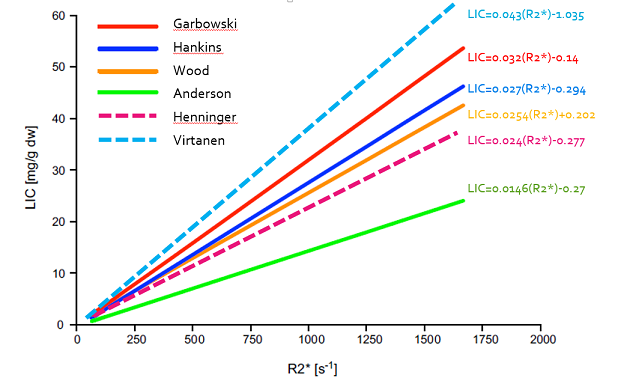
Si vous souhaitez une comparaison plus complète des études je vous conseille de lire l'article de Henninger.
Il faut redoubler de prudence avec les maps calculées par des séquences 3D dédiées car elles font une estimation pixel par pixel et elles deviennent très hétérogènes en cas de très forte surcharge en fer, quelque soit le constructeur.
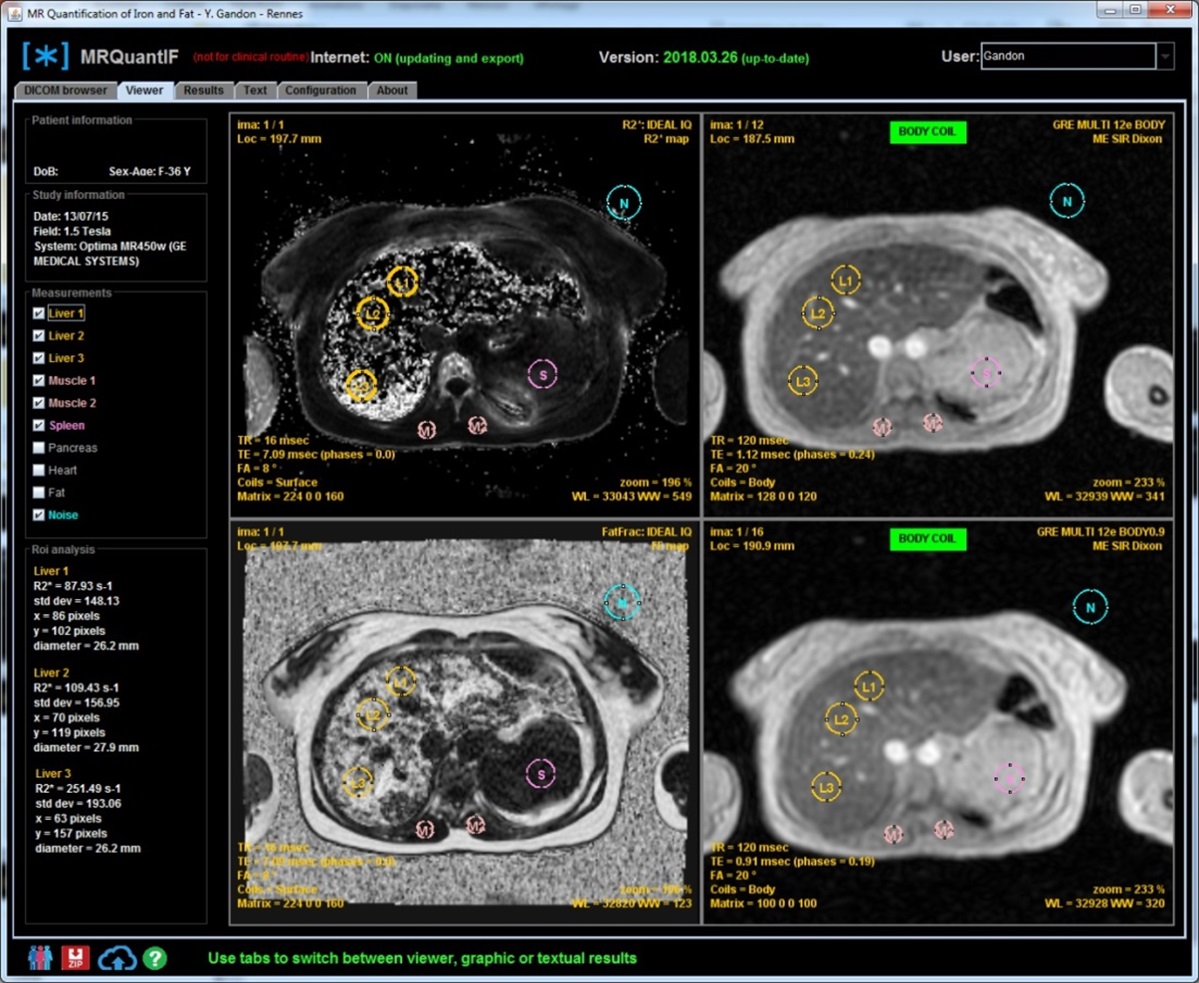
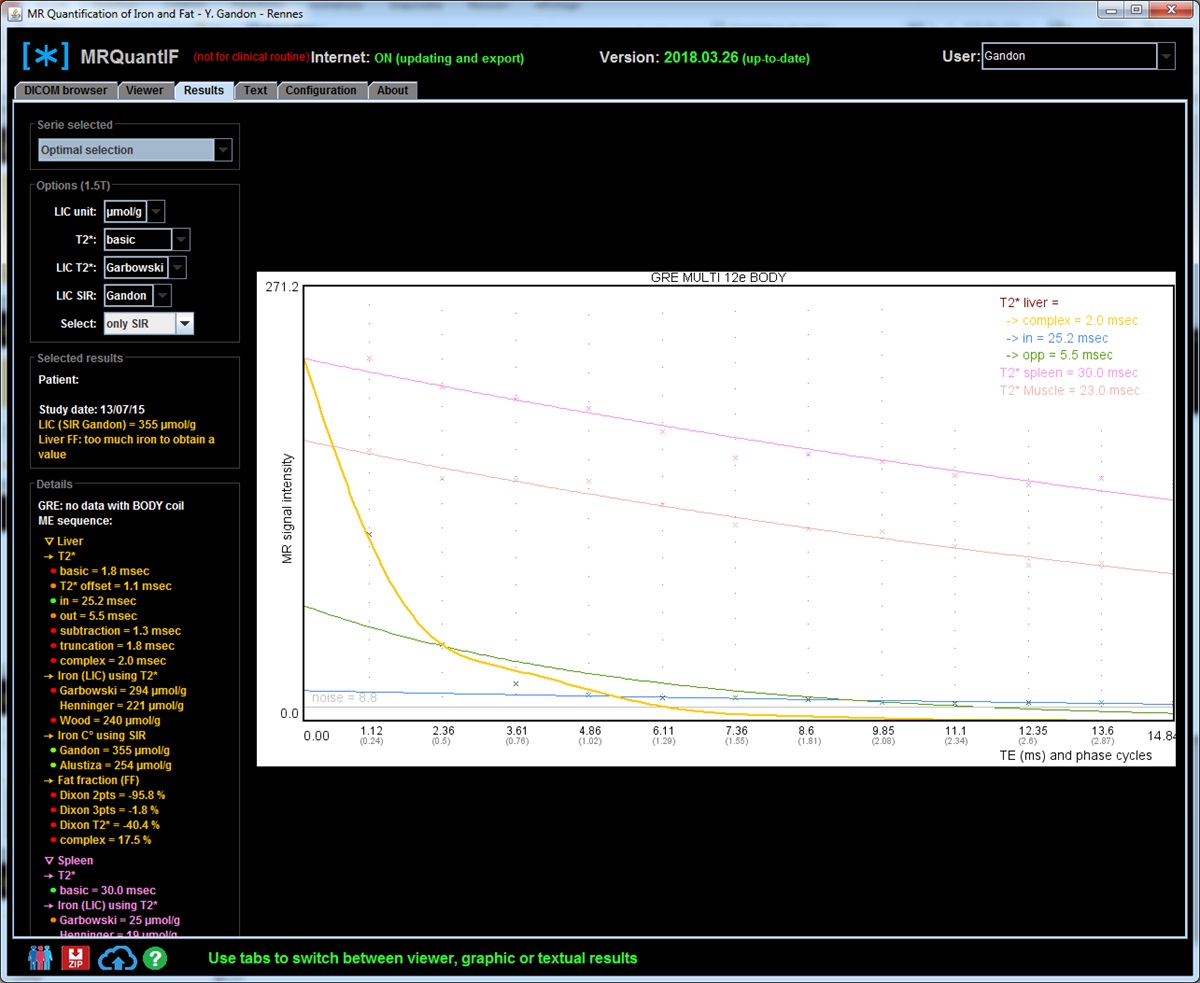
A 3 Tesla
Jusqu'à présent seule notre étude a été publiée :
| Ref | Patients | With biopsies | LIC range (mg/g) |
Sequence | Matrix | TR (ms) |
FA (°) |
TE-min (ms) |
delta-TE (ms) |
N TEs | TE-max (ms) |
Comment | Method | Correlation (R) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
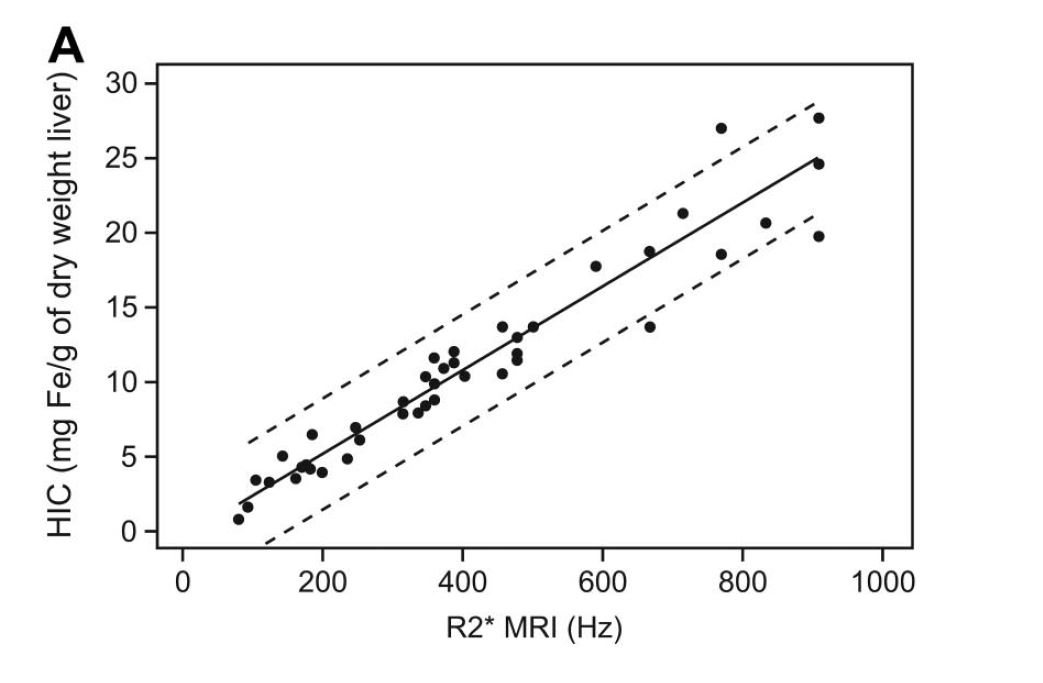
| d'Assignies Eur Radiol 2018 |
105 patients | 105: hemochromatosis (n=31) DIOS (n=22) others (n=3) controls (n=49) |
0-35 | GRE multi echo |
106×128 | 120 | 20 | 1.2 | 1.2 | 10 | 12 | subtraction | 0.95 | |
| A total of 105 biopsies | ||||||||||||||
Cette étude montre qu'avec un TE minimum de 1.2 ms on ne peut calculer correctement un T2* que pour des surcharges faibles ou modérées, inférieure à 120µmol/g. On ne peut se baser uniquement sur le résultat du T2* car des surcharges supérieures peuvent être responsables d'une important sous-estimation de la concentration en fer. Il faut donc, de préférence, comparer à l'estimation obtenue selon la méthode SIR et pour cela réaliser la séquence que nous proposons avec l'antenne body afin de pouvoir comparer le signal entre le foie et les muscles. Si cette séquence n'a pas été obtenue, il ne faut pas se fier à un résultat fourni par un calcul du T2* (ou R2*) s'il est discordant avec le signal observé. Encore plus qu'à 1.5T, les maps calculées par des séquences 3D dédiées deviennent très hétérogènes et erronées en cas de surcharge majeure.
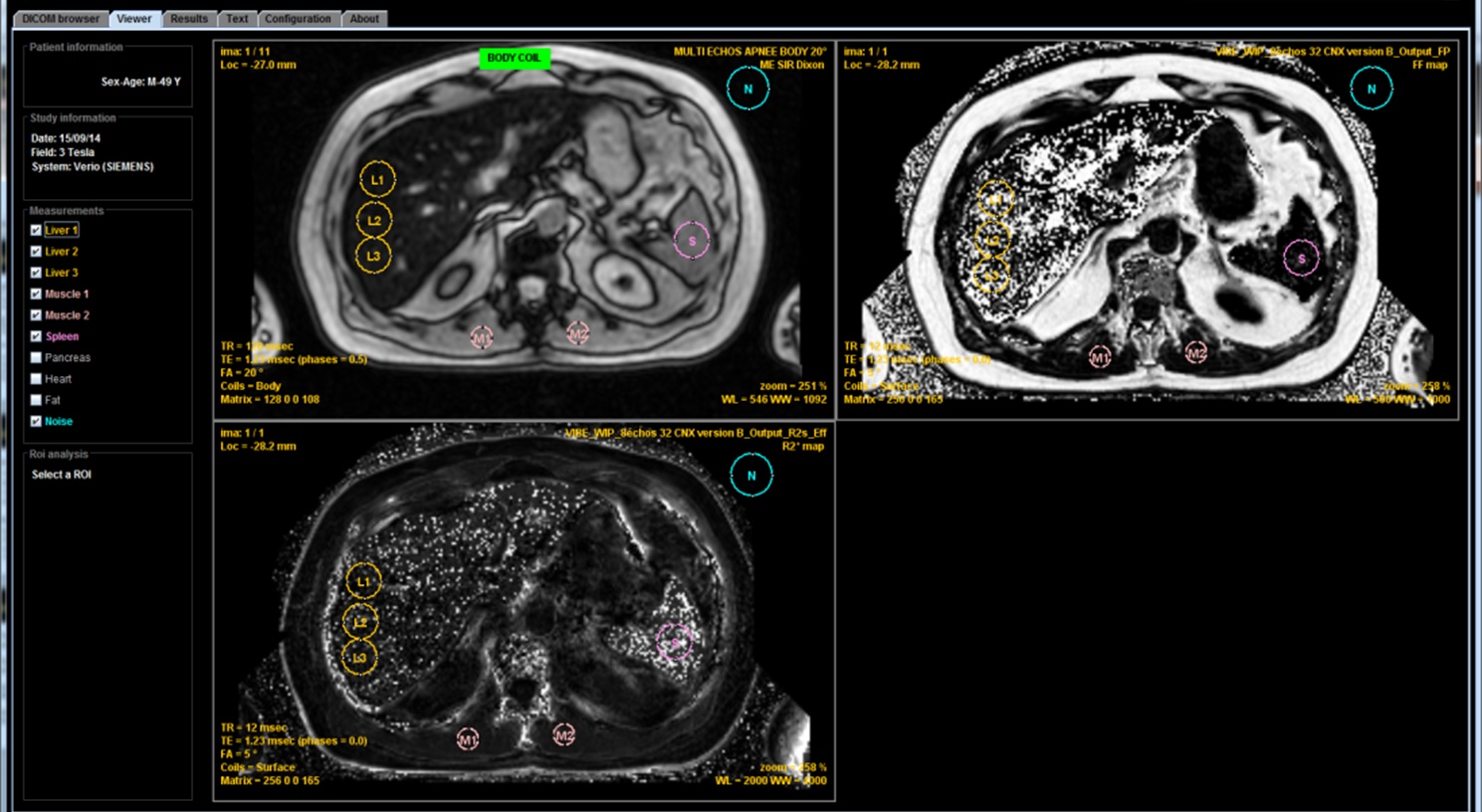
Quel que soit le champ magnétique, des questions ne sont pas encore résolues :
- Quelles différences obtient-on en pratique avec les diverses méthodes de calcul du T2* ? La méthode de substraction donne des valeurs inférieures mais pour le reste ce n'est pas forcément simple de répondre car cela dépend de plusieurs facteurs dont les principaux sont la présence d'une stéatose associée ou encore l'importance de la surcharge. Cela devient encore plus complexe de répondre à cette question si l'on considère les maps produites par les séquences 3D spécifiques proposées par les constructeurs car les méthodes de calcul peuvent être complexes.
- Et donc quel écart observera-t-on entre deux examens pratiqués chez le même patient à 1.5 et à 3T ?
Avantages et inconvénients des deux méthodes
| Méthode | Avantages | Inconvénients |
|---|---|---|
| SIR |
|
|
| R2* |
|
|

Quantification de la stéatose
L'objectif est de calculer la fraction graisseuse hépatique (le % de graisse dans le foie).
En scanner, la densité baisse d'environ 18 UH par 10% de graisse (NB: en effet la graisse sous-cutanée (100% de graisse) est au maximum à -120 UH soit une différence de 180 UH avec le foie normal). On comprend devant la variation individuelle de la densité hépatique (60 à 75 UH) que l'on ne pourra pas quantifier des faibles surcharges. Il peut aussi y avoir d'autres facteurs influençant la densité hépatique. En revanche le scanner est fiable pour les surcharges moyennes et supérieures car la forte baisse de signal est spécifique.
Une estimation peut être proposée par cette formule :
Après injection on ne peut plus quantifier correctement.
En IRM, on se base sur la légère variation de fréquence de résonance des protons selon leur environnement moléculaire. Les protons de l'eau sont associés à l'oxygène, ceux de la graisse au carbone. Ceci est responsable de l'effet de phase en écho de gradient. Il s'observe uniquement quand il y a au sein d'un voxel (volume élémentaire de l'image) un mélange de composant hydrique et de composant graisseux. Selon le temps d'écho le décalage de l'orientation globale du signal résultant pour l'eau et la graisse peut être plus ou moins décalé. A 1,5T les protons de l'eau et de la graisse sont en phase pour des TE multiples de 4.8 ms. Aux temps intermédiaires (2,4 ms, 7,2 ms ...) le signal est en opposition de phase. Il faut diviser par deux les TE à 3T.
De façon sommaire le pourcentage de graisse est estimé par la mesure du signal du foie sur l'écho en phase et sur l'écho en opposition de phase d'une séquence (DUAL, IPOP, Dixon ...) :
Mais pour être plus précis il faut réaliser une séquence en écho de gradient avec de nombreux échos (une dizaine par exemple) afin d'obtenir l'évolution sinusoïdale du signal en fonction du TE. Utilisez le module de simulation en mettant un pourcentage de graisse dans le foie (20 à 30 % par exemple) et vous comprendrez bien le signal que l'on obtient. Cette séquence peut être:
- soit la séquence générique que nous proposons, disponible dans le package de base (sauf chez General Electric qui propose une option STARMAP) qu'il faut ensuite traiter avec l'outil on-line ou avec le logiciel java MRQuantif
- soit une séquence spécifique proposée par le constructeur (IDEAL IQ, mDixon-Quant, VIBE-Dixon) qui fournit une carte de graisse.
On n'a pas de bénéfice particulier à utiliser l'antenne du tunnel mais comme on veut faire la quantification du fer en même temps c'est ce que l'on recommande.
En cas de forte surcharge en fer (>150 µmol/g de foie) il n'est plus possible de quantifier la stéatose car l'effondrement du signal ne permet plus d'obtenir de signal correctement quantifiable au TE en phase.
En histologie, en cas de surcharge hépatique en graisse, des vacuoles lipidiques apparaissent dans le cytoplasme des hépatocytes. Elles sont plus ou moins nombreuses et de taille variable. Un grade semi-quantitatif permet d'apprécier le pourcentage d'hépatocytes qui contiennent des vacuoles. Ainsi, si tous les hépatocytes contiennent au moins une vacuole on obtient un grade de 100% mais cela ne veut pas dire que la concentration en graisse hépatique est de 100%. Si l'on veut obtenir une fraction graisseuse qui peut être comparée à la quantification en graisse obtenue par IRM il faut soit analyser biochimiquement le fragment biopsique soit estimer, et c'est plus simple, la proportion en surface des vacuoles par rapport à la totalité du tissu. Des méthodes d'histomorphométrie on été publiées.
L'IRM utilise la légère variation de fréquence de résonance de la graisse par rapport à l'eau pour dissocier les deux composantes et les quantifier.
Il y a plusieurs environnements des atomes d'hydrogènes selon les liaisons avec l'atome de carbone. Chaque environnement est responsable d'une petite différence de fréquence. Hamilton a quantifié la répartition habituelle des principaux composants et leur écart en ppm par rapport au pic de l'eau.
| Composant | Proportion (%) |
Ecart/eau (ppm) |
Delta en fréquence (hz) |
Cycle de phase (ms) |
1.5T | 3T | 1.5T | 3T | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 70 | -3.4 | -217 | -434 | 4.6 | 2.3 | |||||||||
| 12 | -2.6 | -166 | -332 | 6 | 3.0 | |||||||||
| 8.8 | -3.7 | -242 | -485 | 4.12 | 2.06 | |||||||||
| 4.7 | 0.7 | 38 | 77 | 26.3 | 13.1 | |||||||||
| 3.9 | -0.4 | -32 | -64 | 31.2 | 15.6 | |||||||||
| 0.6 | -2.75 | -125 | -249 | 2.0 | 4.01 | |||||||||
| En moyenne on observe un cycle de phase de 4.8ms à 1.5T et de 2.4 ms à 3T. | ||||||||||||||
On dispose donc de deux méthodes principales pour quantifier la stéatose hépatique (et d'une façon générale toute infiltration de graisse microscopique) : soit l'analyse spectroscopique au sein d'un volume d'analyse, soit l'imagerie de phase en étudiant la variation du signal (et ou de la phase) à partir d'images obtenues par de multiples TE. Bien sûr cette acquisition doit être de préférence une séquence unique avec de multiples échos, comme pour le calcul du T2*.
Spectroscopie IRM ou spectroMR
La technique de spectroMR est théoriquement la plus performante pour une quantification exacte de la stéatose. Elle a été validée par rapport à la biopsie en se comparant le plus souvent par rapport au grade. Elle serait particulièrement intéressante si l'on pouvait analyser les variations de proportion des différents composants mais en pratique l'acquisition reste difficile imposant une bonne compensation de l’homogénéité du champ magnétique (shim). Elle manque souvent de robustesse, en particulier en cas de présence d'une surcharge hépatique en fer même peu marquée. L'acquisition en apnée est maintenant possible mais l'information est limitée en comparaison à ce que l'on peut obtenir pour d'autres organes immobiles.
Aussi l’utilisation de la spectroMR n’est pas de pratique quotidienne pour la quantification de la stéatose. Ce d’autant que les méthodes plus simples à mettre en oeuvre et basées sur l'imagerie de phase ont été proposées.
Imagerie de phase
Elle est basée sur l’utilisation de séquences en écho de gradient comportant des TEs :
- en-phase (multiples de 4,8ms à 1,5T et de 2,4ms à 3T) avec le signal de la graisse et du tissu hépatique (l’eau) qui s’additionnent,
- et en opposition de phase avec le signal de la graisse qui est soustrait au signal hépatique. Le premier TE en opposition de phase est, à 1.5T, de 2,4ms et les suivants sont espacés de 4,8 ms soit 7,2ms, 12ms etc, et à 3T de 2,4ms et les suivants espacés de 2,4ms soit 3,6ms ; 6ms etc.
Ainsi la différence de signal entre les 2 acquisitions en phase et en opposition de phase correspond au signal de la graisse. La formule de DIXON utilisant ces deux points est simple :